|
Белки́ (протеи́ны, полипепти́ды) —
высокомолекулярные
органические вещества, состоящие из соединённых в цепочку
пептидной связью
аминокислот. В живых организмах аминокислотный состав белков определяется
генетическим кодом, при синтезе в большинстве случаев используется 20
стандартных аминокислот. Множество их комбинаций дают большое разнообразие
свойств молекул белков. Кроме того, аминокислоты в составе белка часто
подвергаются
посттрансляционным модификациям, которые могут возникать и до того, как
белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в
живых организмах несколько молекул белков образуют сложные комплексы, например,
фотосинтетический комплекс
Функции белков в
клетках живых организмов более разнообразны, чем функции других
биополимеров —
полисахаридов и
ДНК.
Так, белки-ферменты
катализируют протекание биохимических реакций и играют важную роль в обмене
веществ. Некоторые белки выполняют структурную или механическую функцию, образуя
цитоскелет,
поддерживающий форму клеток. Также белки играют важную роль в сигнальных
системах клеток, при
иммунном ответе и в
клеточном цикле.
Белки — важная часть питания
животных и
человека, поскольку в их организме не могут синтезироваться все необходимые
аминокислоты и часть из них поступает с белковой пищей. В процессе
пищеварения
ферменты разрушают потреблённые белки до аминокислот, которые используются
при
биосинтезе белков организма или подвергаются дальнейшему распаду для
получения энергии.
Определение аминокислотной последовательности первого белка —
инсулина —
методом
секвенирования белков принесло
Фредерику Сенгеру
Нобелевскую премию в
1958 году.
Первые трёхмерные структуры белков
гемоглобина
и миоглобина
были получены методом
дифракции
рентгеновских лучей, соответственно,
Максом Перуцем и
Джоном Кендрю в
1958 году,
за что в 1962
году они получили
Нобелевскую премию по
химии.
История изучения
 Антуан Франсуа де Фуркруа, основоположник изучения белков
Антуан Франсуа де Фуркруа, основоположник изучения белков
Белки были выделены в отдельный класс биологических
молекул в
XVIII веке
в результате работ французского химика
Антуана Фуркруа и других учёных, в которых было отмечено свойство белков
коагулировать (денатурировать)
под воздействием нагревания или
кислот. В то время были исследованы такие белки, как
альбумин («яичный белок»),
фибрин (белок
из крови) и
глютен из зерна
пшеницы.
Голландский химик
Геррит Мульдер провёл анализ состава белков и выдвинул гипотезу, что
практически все белки имеют сходную
эмпирическую формулу. Термин «протеин» для обозначения подобных молекул был
предложен в
1838 году сотрудником Мульдера
Якобом Берцелиусом .
Мульдер также определил продукты разрушения белков —
аминокислоты и для одной из них (лейцина)
почти точно определил молекулярную массу — 131
дальтон. В 1836 Мулдер предложил первую модель химического строения белков.
Основываясь на теории
радикалов он сформулировал понятие о минимальной структурной единице состава
белка, C16H24N405, которая была
названа протеин (Pr), а теория — теорией протеина . По
мере накопления новых данных о белках теория неоднократно подвергалась критике,
но до конца 1850-х оставалась общепризнанной.
К концу XIX века было исследовано большинство аминокислот, которые входят в
состав белков. В 1894 году немецкий физиолог
Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты
являются основными структурными элементами белков.
В начале XX века немецкий химик
Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных
остатков, соединённых пептидными связями. Он же осуществил первый анализ
аминокислотной последовательности белка и объяснил явление протеолиза
Однако центральная роль белков в организмах не была признана до
1926 года,
когда американский химик
Джеймс Самнер (впоследствии — лауреат
Нобелевской премии) показал, что фермент
уреаза была
белком.
Изучению белков препятствовала сложность их выделения. Поэтому первые
исследования белков проводились с использованием тех
полипептидов, которые могли быть очищены в большом количестве, то есть
белков крови,
куриных яиц,
различных токсинов
и пищеварительных/метаболических
ферментов, которые можно было выделить в местах забоя скота. В конце 1950-х
годов компания Armour Hot Dog Co смогла очистить килограмм
бычьей
панкреатической
рибонуклеазы А, которая стала экспериментальным объектом для многих учёных.
Идея о том, что вторичная структура белков образуется в результате
образования
водородных связей между аминокислотами, была высказана
Уильямом Астбери в
1933 году,
но
Лайнус Полинг считается первым учёным, который смог успешно предсказать
вторичную структуру белков. Позднее
Уолтер Каузман, опираясь на работы
Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования
третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В
1949 году
Фред Сенгер определил аминокислотную последовательность
инсулина,
продемонстрировав таким способом, что белки — это линейные полимеры аминокислот,
а не их разветвлённые (как у некоторых
сахаров) цепи,
коллоиды или
циклолы. Первые структуры белков, основанные на
дифракции
рентгеновских лучей на уровне отдельных
атомов были
получены в 1960-х годах и с помощью
ЯМР
в 1980-х годах. В
2006 году
Банк данных о белках (Protein Data Bank) содержал около 40 000 структур
белков.
В XXI веке исследование белков перешло на качественно новый уровень, когда
исследуются не только индивидуальные очищенные белки, но и одновременное
изменение количества и посттрансляционных модификаций большого числа белков
отдельных клеток,
тканей или организмов. Эта область биохимии называется
протеомикой.
С помощью методов
биоинформатики стало возможно не только обработать данные
рентгенно-структурного анализа, но и предсказать структуру белка, основываясь на
его аминокислотной последовательности. В настоящее время криоэлектронная
микроскопия больших белковых комплексов и предсказание малых белков и
доменов больших белков с помощью компьютерных программ по точности приближаются
к разрешению структур на атомном уровне.
Свойства
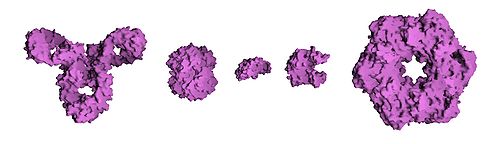 Сравнительный размер белков. Слева направо:
Антитело (IgG),
гемоглобин,
инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза
(фермент)
Сравнительный размер белков. Слева направо:
Антитело (IgG),
гемоглобин,
инсулин (гормон), аденилаткиназа (фермент) и глютаминсинтетаза
(фермент)
Размер белка может измеряться в числе аминокислот или в
дальтонах (молекулярная
масса), чаще из-за относительно большой величины молекулы в производных
единицах — килодальтонах (кДа). Белки дрожжей, в
среднем, состоят из 466 аминокислот и имеют молекулярную массу 53 кДа. Самый
большой из известных в настоящее время белков — титин (другие названия: тайтин,
коннектин) — является компонентом
саркомеров
мускулов; молекулярная масса его различных изоформ варьирует в интервале от
3 000 до 3 700 кДа, а общая длина 38 138 аминокислот (в человеческой мышце
solius).
Белки также являются
амфотерными
полиэлектролитами (полиамфолитами), при этом группами, способными к ионизации в растворе,
являются
карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая
и
глутаминовая кислоты) и азотсодержащие боковых цепей основных аминокислот (в
первую очередь ω-аминогруппа лизина и
амидиновый остаток CNH(NH2)
аргинина, в
несколько меньшей степени —
имидазольный остаток
гистидина).
Белки как полиамфолиты характеризуются изоэлектрической точкой (pI) —
кислотностью среды рН,
при которой молекула данного белка не несёт
электрического заряда и, соответственно, не перемещаются в электрическом
поле (например, при
электрофорезе). Величина pI определяется отношением кислотных и основных
аминокислотных остатков в белке: увеличение количества остатков основных
аминокислот в данном белке ведёт к увеличению pI; увеличение количества остатков
кислых аминокислот приводит к снижению значения pI.
Значение изоэлектрической точки является характерной константой белков. Белки
с pI меньше 7 называются кислотными, а белки с pI больше 7 считаются основными.
В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка
большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако
некоторых случаях значения лежат в экстремальных областях так, например, для пепсина —
протеолетического фермента сильнокислого желудочного сока pI ~ 1,
а для сальмина — белка-протамина молок лосося,
особенностью которого является чрезвычайно высокое содержание аргинина, pI ~ 12.
Белки, связывающиеся с
нуклеиновыми кислотами за счёт электростатического взаимодействия с
фосфатными остатками нуклеиновых кислот часто являются основными белками.
Примером таких белков служат
гистоны и
протамины.
По степени растворимости в воде белки бывают растворимыми (гидрофильные) и
нерастворимыми (гидрофобные). К последним относятся большинство входящих в
состав
биологических мембран интегральных мембранных белков, которые
взаимодействуют с гидрофобными
липидами
мембраны.
Денатурация
 Необратимая денатурация белка куриного яйца под воздействием высокой
температуры
Необратимая денатурация белка куриного яйца под воздействием высокой
температуры
-
Основная статья:
Денатурация белков
Как правило, белки сохраняют структуру и, следовательно, физико-химические
свойства, например,
растворимость в условиях, таких как
температура и
рН,
к которым приспособлен данный организм.
Резкое изменение этих условий, например, нагревание или обработка белка
кислотой или
щёлочью приводит к потере четвертичной, третичной и вторичной структур
белка, называемой денатурацией. Самый известный случай денатурации белка в
быту — это приготовление куриного яйца, когда под воздействием высокой
температуры растворимый в воде прозрачный белок
овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в
некоторых случаях обратима, как в случае осаждения (преципитации)
водорастворимых белков с помощью солей аммония, и
используется как способ их очистки.
Простые и сложные белки
-
Основные статьи:
Простые белки,
Сложные белки
Все белки разделяют на две большие группы — простые и сложные белки. Простые
белки содержат только аминокислоты, сложные белки имеют также неаминокислотные
группы. Эти дополнительные группы в составе сложных белков называются
«простетическими группами». Примерами простетических групп в составе белков
служат гем (в составе
гемоглобина),
витамины тиамин и
биотин.
Неорганические простетические группы состоят из ионов металлов —
цинка,
магния и
молибдена .
Структура белка
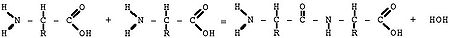 Схематическое изображение образования пептидной связи (справа).
Подобная реакция происходит в молекулярной машине по образованию
белка —
рибосоме
Схематическое изображение образования пептидной связи (справа).
Подобная реакция происходит в молекулярной машине по образованию
белка —
рибосоме
Молекулы
белков представляют собой линейные
полимеры, состоящие из
α-L-аминокислот (которые являются
мономерами)
и, в некоторых случаях, из модифицированных основных аминокислот (правда,
модификации происходят уже после синтеза белка на
рибосоме).
Для обозначения
аминокислот в научной литературе используются одно- или трёхбуквенные
сокращения. Хотя на первый взгляд может показаться, что использование в
большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие
белковых структур, на самом деле количество вариантов трудно переоценить: для
цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка
из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130
вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков
часто называют пептидами, при большей степени полимеризации — белками,
хотя это деление весьма условно.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2)
одной аминокислоты с α-карбоксильной группой (-СООН) другой аминокислоты
образуются
пептидные связи. Концы белка называют С- и N- концом (в зависимости от того,
какая из групп концевой аминокислоты свободна: -COOH или -NH2,
соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются
к C-концу, поэтому название пептида или белка даётся путём перечисления
аминокислотных остатков начиная с N-конца.
Последовательность аминокислот в белке соответствует
информации, содержащейся в
гене данного белка.
Эта информация представлена в виде последовательности
нуклеотидов, причём одной аминокислоте соответствует одна или несколько
последовательностей из трёх нуклеотидов — так называемых
триплетов или
кодонов. То, какая
аминокислота соответствует данному кодону в
мРНК определяется
генетическим кодом, который может несколько отличаться у разных организмов.
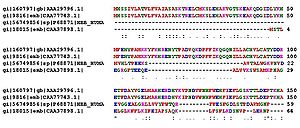 Сравнение аминокислотных последовательностей белков (в данном
случае —
гемоглобинов) из разных организмов позволяет определять участки,
важные для функционирования белков, а также эволюционную историю
сравниваемых видов
Сравнение аминокислотных последовательностей белков (в данном
случае —
гемоглобинов) из разных организмов позволяет определять участки,
важные для функционирования белков, а также эволюционную историю
сравниваемых видов
Гомологичные белки (выполняющие одну функцию и, предположительно, имеющие
общее эволюционное происхождение, например,
гемоглобины)
разных организмов имеют во многих местах цепи различные аминокислотные остатки,
называемые вариабельными, в противоположность консервативным,
общим остаткам. По степени гомологии возможна оценка эволюционного расстояния
между таксонами,
к которым принадлежат сравниваемые организмы.
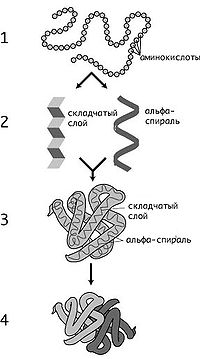
Уровни структуры белков: 1 — первичная, 2 — вторичная, 3 —
третичная, 4 — четвертичная
Уровни структуры белка
Кроме последовательности аминокислот полипептида (первичной структуры),
крайне важна трёхмерная структура белка, которая формируется в процессе
фолдинга (от
англ. folding), «сворачивание»).
Трёхмерная структура формируется в результате взаимодействия структур более
низких уровней. Выделяют четыре уровня структуры белка:
- Первичная структура — последовательность аминокислот в
полипептидной цепи. Важными особенностями первичной структуры являются
консервативные мотивы — сочетания аминокислот, важных для функции белка.
Консервативные мотивы сохраняются в процессе
эволюции
видов, по ним можно предсказать функцию неизвестного белка.
- Вторичная структура — локальное упорядочивание фрагмента
полипептидной цепи, стабилизированное
водородными связями и
гидрофобными взаимодействиями. Ниже приведены некоторые распространённые
типы вторичной структуры белков:
-
- α-спирали — плотные витки вокруг длинной оси молекулы, один виток
составляют 3,6 аминокислотных остатка, спираль стабилизирована
водородными связями между H и O пептидных групп, отстоящих друг от друга
на 4 звена. Спираль построена исключительно из одного типа
стереоизомеров аминокислот (L), хотя она может быть как левозакрученной,
так и правозакрученной, в белках преобладает правозакрученная. Спираль
нарушают электростатические взаимодействия
глутаминовой кислоты,
лизина,
аргинина,
близкорасположенные
аспарагин,
серин,
треонин
и лейцин
могут стерически мешать образованию спирали, пролин
вызывает изгиб цепи и также нарушает α-спирали.
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных
цепей, в которых водородные связи образуются между относительно
удалёнными друг от друга в первичной структуре аминокислотами или
разными цепями белка, а не близко расположенными, как имеет место в
α-спирали. Эти цепи обычно направлены N-концами в противоположные
стороны (антипараллельная ориентация). Для образования β-листов важны
небольшие размеры R-групп аминокислот, преобладают обычно глицин
и аланин.
- π-спирали;
- 310-спирали;
- неупорядоченные фрагменты.
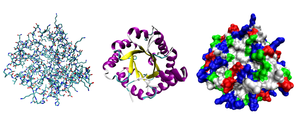 Разные способы изображения трёхмерной структуры белка на примере
фермента триозофосфатизомеразы. Слева — «палочковая» модель, с
изображением всех атомов и связей между ними; цветами показаны
элементы. В середине изображены структурные мотивы, α-спирали и
β-листы. Справа изображена контактная поверхность белка, на
основании
Ван-дер-Ваальсовых радиусов атомов; цветами показаны особенности
активности участков
Разные способы изображения трёхмерной структуры белка на примере
фермента триозофосфатизомеразы. Слева — «палочковая» модель, с
изображением всех атомов и связей между ними; цветами показаны
элементы. В середине изображены структурные мотивы, α-спирали и
β-листы. Справа изображена контактная поверхность белка, на
основании
Ван-дер-Ваальсовых радиусов атомов; цветами показаны особенности
активности участков
- Третичная структура
- — пространственное строение полипептидной цепи — взаимное расположение
элементов вторичной структуры, стабилизированное взаимодействием между
боковыми цепями аминокислотных остатков. В стабилизации третичной структуры
принимают участие:
-
ковалентные связи (между двумя
цистеинами —
дисульфидные мостики);
-
ионные (электростатические)
взаимодействия (между противоположно заряженными аминокислотными
остатками);
- водородные связи;
-
гидрофобные взаимодействия.
Белки разделяют на группы согласно их трёхмерной структуре. Например,
изображённый на картинке справа белок,
триозофосфатизомераза, состоит из восьми α-спиралей, расположенных на
внешней поверхности структуры и восьми параллельных β-слоёв внутри структуры.
Белки с подобным тёхмерным строением называются αβ-баррелы (от англ. barrel —
бочка)
.
- Четверичная структура
- — субъединичная структура белка. Взаимное расположение нескольких
полипептидных цепей в составе единого белкового комплекса.
Также выделяют:
- Трёхмерную структуру белка — набор пространственных координат,
составляющих белок
атомов.
- Субъединичную (доменную)
структуру белка — последовательность участков белка, имеющих известную
функцию или определённую трёхмерную структуру.
- Гидрофобное ядро, обеспечивающее сворачивание белка.
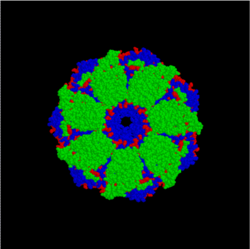 Изображение модели комплекса бактериальных шаперонов GroES и GroEL
(вид сверху). Аггрегированный белок поступает в центральную полость
комплекса, где в результате
гидролиза
АТФ происходит изменение его структуры
Изображение модели комплекса бактериальных шаперонов GroES и GroEL
(вид сверху). Аггрегированный белок поступает в центральную полость
комплекса, где в результате
гидролиза
АТФ происходит изменение его структуры
Образование и поддержание структуры белков в живых
организмах
-
Основная статья:
Шапероны
Способность белков восстанавливать правильную трёхмерную структуру после
денатурации позволила выдвинуть гипотезу о том, что вся информация о конечной
структуре белка содержится в его аминокислотной последовательности. В настоящее
время общепризнана теория о том, что в результате эволюции стабильная
конформация белка обладает минимальной
свободной энергией по сравнению с другими возможными конформациями этого
полипептида.
Тем не менее, в клетках существует группа белков, функция которых —
обеспечение восстановления структуры белков после повреждения, а также создание
и диссоциация белковых комплексов. Эти белки называются шаперонами. Концентрация
многих шаперонов в клетке возрастает при резком повышении температуры окружающей
среды, поэтому они относятся к группе Hsp (англ. heat shock proteins — белки
теплового шока).
Важность нормальной работы шаперонов для функционирования организма может быть
проиллюстрирована на примере шаперона, α-кристаллина,
входящего в состав
хрусталика глаза человека.
Мутации в этом белке приводят к помутнению хрусталика из-за аггрегирования
белков и, как результат, к катаракте.
Синтез белков
Химический синтез
Короткие белки могут быть синтезированы химическим путём с помощью группы
методов, которые используют
органический синтез — например,
химическое лигирование.
Большинство методов химического синтеза проходят в направлении от С-конца к
N-концу, в противоположность биосинтезу. Таким образом можно получить короткий
иммунногенный пептид (эпитоп),
необходимый для получения антител путём инъекции в животных, или получения
гибридо́м;
химический синтез также используется для получения ингибиторов некоторых
ферментов.
Химический синтез позволяет вводить искусственные, то есть не встречающиеся в
обычных белках аминокислоты — например, присоединять
флюоресцентные метки к боковым цепям аминокислот. Однако химические методы
синтеза неэффективны при длине белков более 300 аминокислот; кроме того,
искусственные белки могут иметь неправильную третичную структуру, и у
аминокислот искусственных белков отсутствуют посттрансляционные модификации.
Биосинтез белков
-
Основная статья:
Биосинтез белка
Универсальный способ: рибосомный синтез
 Молекулярная модель малой (слева) и большой (справа) субъединиц
бактериальной рибосомы — молекулярной машины, синтезирующей белки.
Голубым цветом показаны белки в составе рибосомы, но основную
структурную роль выполняет
рРНК
Молекулярная модель малой (слева) и большой (справа) субъединиц
бактериальной рибосомы — молекулярной машины, синтезирующей белки.
Голубым цветом показаны белки в составе рибосомы, но основную
структурную роль выполняет
рРНК
Белки синтезируются живыми организмами из аминокислот на основе информации,
закодированной в генах.
Каждый белок состоит из уникальной последовательности аминокислот, которая
определяется нуклеотидной последовательностью гена, кодирующего данный белок.
Генетический код составляется из трёхбуквенных «слов», называемых
кодонами; каждый
кодон отвечает за присоединение к белку одной аминокислоты: например, сочетание
АУГ соответствует метионину.
Поскольку ДНК состоит из четырёх типов
нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках
используется 20 аминокислот, то многие аминокислоты определяются более, чем
одним кодоном. Гены, кодирующие белки сначала
транскрибируются в последовательность нуклеотидов матричной РНК (мРНК)
белками
РНК-полимеразами.
У
прокариот мРНК может считываться рибосомами
в аминокислотную последовательность белков сразу после транскрипции, а у
эукариот она
транспортируется из ядра в цитоплазму, где находятся рибосомы. Скорость
синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду.
Процесс синтеза белка с мРНК называется трансляцией.
Во время начальной стадии биосинтеза белков, инициации, обычно метиониновый
кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых
факторов инициации присоединена метиониновая транспортная РНК (тРНК).
После узнавания стартового кодона к малой субъединице присоединяется большая
субъединица и начинается вторая стадия трансляции — элонгация. При каждом
движении рибосомы от 5' к 3' концу мРНК считывается один кодон путём образования
водородных связей между тремя нуклеотидами (кодоном)
мРНК и комплементарным ему антикодоном транспортной РНК, к которой присоединена
соответствующая аминокислота. Синтез
пептидной связи катализируется рибосомальной РНК
рРНК, образующей пептидилтрансферазный центр рибосомы. Рибосомальная РНК (рРНК)
катализирует образование пептидной связи между последней аминокислотой растущего
пептида и аминокислотой, присоединённой к тРНК, позиционируя атомы азота и
углерода в
положении, благоприятном для прохождения реакции. Ферменты
аминоацил-тРНК-синтетазы присоединяют аминокислоты к их тРНК. Третья, и
последняя стадия трансляции, терминация, происходит при достижении рибосомой
стоп-кодона, после чего белковые
факторы терминации гидролизуют
последнюю тРНК от белка, прекращая его синтез. Таким образом, в рибосомах белки
всегда синтезируются от N- к C- концу.
Нерибосомный синтез
У низших
грибов и некоторых бактерий существует менее распространённый способ
биосинтеза белков, который не требует участия рибосом. Синтез пептидов, обычно
вторичных метаболитов, проводится высокомолекулярным белковым комплексом,
так называемой НРС-синтазой. НРС-синтаза обычно состоит из нескольких доменов или
отдельных белков, осуществляющих селекцию аминокислот, образование пептидной
связи, высвобождение синтезированного пептида и, иногда, домен, способный
изомеризовать L-аминокислоты (нормальная форма) в D-форму.
Внутриклеточный транспорт и сортировка белков
Основная статья:
Внутриклеточная сортировка белков
Синтезируемые в цитоплазме на рибосомах белки должны попадать в разные
компартменты клетки —
ядро,
митохондрии, ЭПР,
аппарат Гольджи,
лизосомы и
др., а некоторые белки должны попасть во внеклеточную среду. Для попадания в
определенный компартмент белок должен обладать специфической меткой. В
большинстве случаев такой меткой является часть аминокислотной
последовательности самого белка (лидерный пептид, или
сигнальная последовательность белка). В некоторых случаях меткой служат
посттрансляционно присоединенные к белку олигосахариды. Транспорт белков в ЭПР
осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с
сигнальной последовательностью для ЭПР, «садятся» на специальные
транслокационные комплексы на мембране ЭПР. Из ЭПР в аппарат Гольджи, а оттуда в
лизосомы, на внешнюю мембрану или во внеклеточную среду белки попадают путем
везикулярного транспорта. В ядро белки, обладающие сигнальной
последовательностью для ядра, попадают через
ядерные
поры. В митохондрии и хлоропласты белки, обладающие соответствующими
сигнальными последовательностями, попадают через специфические белковые
поры-транслокаторы при участии шаперонов.
Посттрансляционная модификация белков
-
Основная статья:
Посттрансляционная модификация
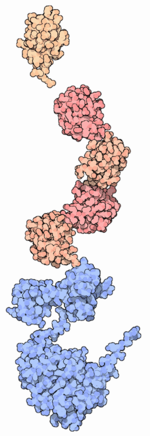 Молекулы убиквитина (оранжевые и розовые) присоединены к белку Src
(голубой), предвещая его деградацию
Молекулы убиквитина (оранжевые и розовые) присоединены к белку Src
(голубой), предвещая его деградацию
После завершения трансляции и высвобождения белка из рибосомы аминокислоты в
составе полипептидной цепи подвергаются разнообразным химическим модификациям.
Примерами посттрансляционной модификации являются:
- присоединение различных функциональных групп (ацетил-,
метил- и
фосфатных групп);
- присоединение
липидов и
углеводородов;
- изменение стандартных аминокислот на нестандартные (образование
цитруллина);
- образование структурных изменений (образование дисульфидных мостиков
между
цистеинами);
- удаление части белка как в начале (сигнальная последовательность), так и
в отдельных случаях в середине (инсулин);
- добавление небольших белков, которые влияют на деградацию белков
(сумоилирование и
убиквитинирование).
При этом тип модификации может быть как универсальным (добавление цепей,
состоящих из мономеров убиквитина, служит сигналом для деградации этого белка
протеосомой), так и специфическим для данного белка.
В то же время один и тот же белок может подвергаться многочисленным
модификациям. Так,
гистоны
(белки, входящие в состав
хроматина у
эукариот) в разных условиях могут подвергаться до 150 различных модификаций.
Функции белков в организме
Так же как и другие биологические макромолекулы (полисахариды,
липиды) и
нуклеиновые кислоты, белки — необходимые компоненты всех
живых организмов,
и участвуют в каждом внутреннем процессе
клетки. Белки
осуществляют
обмен веществ и энергетические превращения. Белки входят в состав клеточных
структур —
органелл или секретируются во внеклеточное пространство для обмена сигналами
между клетками и гидролиза пищевых субстратов. Следует отметить, что
классификация белков по их функции достаточно условна, потому что у эукариот
один и тот же белок может выполнять несколько функций. Хорошо изученным примером
такой многофункциональности служит лизил-тРНК-синтетаза — фермент из класса
аминоацил-тРНК синтетаз, который не только присоединяет лизин к
тРНК, но и
регулирует
транскрипцию нескольких генов.
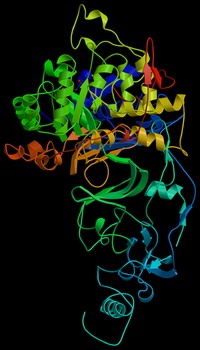 Молекулярная модель фермента
уреазы
бактерии
Helicobacter pylori
Молекулярная модель фермента
уреазы
бактерии
Helicobacter pylori
Каталитическая функция
-
Основная статья:
Ферменты
Наиболее хорошо известная роль белков в организме —
катализ
различных химических реакций.
Ферменты —
группа белков, обладающая специфическими каталитическими свойствами, то есть
каждый фермент катализирует одну или несколько сходных реакций. Ферменты
катализируют реакции расщепления сложных молекул (катаболизм)
и их синтеза (анаболизм),
а также
репликации и
репарации
ДНК и синтезе РНК. Известно несколько тысяч ферментов; среди них такие, как
например пепсин,
расщепляют белки в процессе пищеварения. В процесс пострансляционной модификации
некоторые ферменты добавляют или удаляют химические группы на других белках.
Известно около 4000 реакций, катализируемых белками.
Ускорение реакции в результате ферментативного катализа иногда огромно:
например, реакция, катализируемая ферментом оротат-карбоксилазой протекает в 1017
быстрее некатализируемой (78 миллионов лет без фермента, 18 миллисекунд с
участием фермента).
Молекулы, которые присоединяются к ферменту и изменяются в результате реакции,
называются
субстратами.
Хотя ферменты обычно состоят из сотен аминокислот, только небольшая часть из
них взаимодействует с субстратом, и еще меньшее количество — в среднем 3-4
аминокислоты, часто расположенные далеко друг от друга в первичной
аминокислотной последовательности — напрямую участвуют в катализе.
Часть фермента, которая присоединяет субстрат и содержит каталитические
аминокислоты, называется
активным центром фермента.
Структурная функция
-
Основная статья:
Фибриллярные белки
Структурные белки, как своего рода
арматура,
придают форму жидкому внутреннему содержимому клетки. Большинство структурных
белков являются
филаментозными белками: например, мономеры
актина и
тубулина —
это глобулярные, растворимые белки, но после полимеризации они формируют длинные
нити, из которых состоит
цитоскелет,
позволяющий клетке поддерживать форму.
Коллаген и
эластин — основные компоненты
соединительной ткани (например,
хряща), а из
другого структурного белка
кератина состоят
волосы,
ногти,
перья птиц и некоторые
раковины.
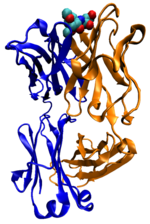 Мышиное антитело против
холеры,
присоединённое к
углеводородному антигену (вверху)
Мышиное антитело против
холеры,
присоединённое к
углеводородному антигену (вверху)
Защитная функция
-
Основная статья:
Антитела
Существуют несколько видов защитных функций белков:
- Физическая защита. В ней принимает участие
коллаген,
белок, поддерживающего структуру кожи. Состоит из
хондроитина и
глюкозамина.
- Химическая защита. Связывание химических токсинов белковыми молекулами —
дезинтоксикация.
- Иммунная защита. Защита с помощью иммуноглобулинов
Белки, входящие в состав
крови, участвуют
в защитном ответе организма как на повреждение, так и на атаку
патогенов.
Примерами первой группы белков служат
фибриногены
и тромбины,
участвующие в свёртывании
крови, а
антитела (иммуноглобулины),
нейтрализуют
бактерии,
вирусы или чужеродные белки. Антитела, входящие в состав
адаптативной иммунной системы, присоединяются к чужеродным для данного
организма веществам,
антигенам, и тем самым нейтрализуют их, направляя к местам уничтожения.
Антитела могут
секретироваться в межклеточное пространство или закрепляться в мембранах
специализированных
В-лимфоцитов, которые называются
плазмоцитами.
В то время как ферменты имеют ограниченное сродство к субстрату, поскольку
слишком сильное присоединение к субстрату может мешать протеканию катализируемой
реакции, стойкость присоединения антител к антигену ничем не ограничено.
Регуляторная функция
-
Основные статьи:
Цитокины,
Активатор (белки),
Протеасома,
Регуляторная функция белков
Многие процессы в организме регулируются небольшими белковыми молекулами,
полипептидными
гормонами и
цитокинами. Примером таких белков служит, соответственно,
инсулин,
который регулирует концентрацию
глюкозы в
крови, и
фактор некроза опухолей,
который передаёт сигналы воспаления между клетками организма.
На внутриклеточном уровне транскрипция генов определяется присоединением
факторов транскрипции —
белков-активаторов и
белков-репрессоров к регуляторным последовательностям генов. На уровне
трансляции считывание многих мРНК также регулируется присоединением белковых
факторов ,
а
деградация РНК и белков также проводится специализированными белковыми
комплексами .
Важнейшую роль в регуляции внутриклеточных процессов играют
протеинкиназы — ферменты, которые активируют или подавляют активность других
белков путем присоединения к ним фосфатных групп.
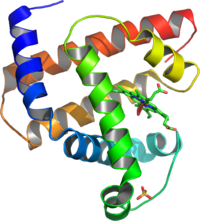 Структура
миоглобин
Структура
миоглобин
|